各学院(部)、研究所:
为进一步加强我校科技伦理工作的规范化建设与有效运行,切实保障伦理审查质量,规范引导涉及人、动物或其他可能带来伦理风险挑战的科研行为,促进负责任创新。根据《西安医学院科技伦理委员会章程(试行)》(西医发〔2024〕130号)及相关工作要求,现就规范伦理审查工作通知如下。
一、伦理审查范围
我校各医疗、教学科研机构开展的涉及人、动物或者其他可能带来伦理风险挑战的科学研究、技术开发等科技活动:
(一)涉及以人为研究参与者的科技活动,包括以人为测试、调查、观察等研究活动的对象,以及利用人类生物样本、个人信息数据等的科技活动:
1.采用物理学、化学、生物学、中医药学等方法对人的生殖、生长、发育、衰老等进行研究的活动;
2.采用物理学、化学、生物学、中医药学、心理学等方法对人的生理、心理行为、病理现象、疾病病因和发病机制,以及疾病的预防、诊断、治疗和康复等进行研究的活动;
3.采用新技术或新产品在人体上进行试验研究的活动;
4.采用流行病学、社会学、心理学等方法收集、记录、使用、报告或者储存有关人的涉及生命科学和医学问题的生物样本、信息数据(包括健康记录、行为等)等科学研究资料的活动。
(二)涉及实验动物的科技活动;
(三)不直接涉及人或实验动物,但可能在生命健康、生态环境、公共秩序、可持续发展等方面带来伦理风险挑战的科技活动;
(四)依据法律、行政法规和国家有关规定需进行科技伦理审查的其他科技活动。
二、伦理审查流程
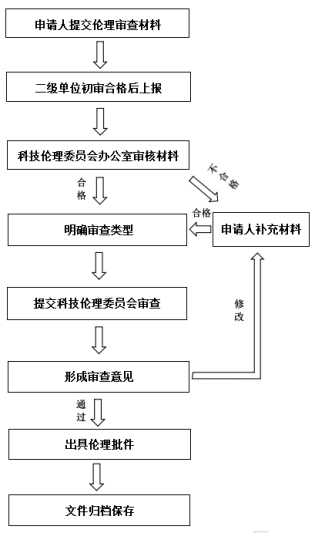
三、伦理审查申请材料
(一)初始审查:申请人在初次申请伦理审查时应向科技伦
理委员会提交下述材料及相关附件。
初始审查所需材料:伦理审查申请汇总表、伦理审查申请表(初始审查)、伦理审查意见反馈表(初始审查),即附件1、附件2和附件4;
(二)跟踪审查:对于已获审批的科技活动,科技伦理委员会办公室将根据相关规定定期开展伦理跟踪审查,必要时可作出暂停或终止科技活动等决定。
跟踪审查所需材料:伦理审查申请汇总表、伦理审查申请表(跟踪审查)、伦理审查意见反馈表(跟踪审查),即附件1、附件3和附件5;
(三)会议审查:经科技伦理委员会办公室审核,需召开伦理审查会议的,根据审查需要,会议可要求申请人到会阐述方案或者就特定问题进行说明。研究者汇报提纲见附件8;
(四)其他材料:知情同意书(如需,可参考附件6或附件7)、知情同意豁免申请(如需,请填写附件9)及其他伦理审查申请者认为所需提供的材料。
四、材料提交
申请人提交伦理审查材料,二级单位初审合格后,统一将签字盖章的申请材料扫描件及相关附件发送至科技伦理委员会邮箱ethics@xiyi.edu.cn。科技伦理委员会办公室(下设科技处行政楼505室)每周五集中受理,形审合格的申请材料将提交科技伦理委员会进行伦理审查。审查通过后科技伦理委员会办公室将通知申请人提交正式纸质材料(一式一份)至科技伦理委员会办公室备案。
注意:形审不合格或伦理审查反馈需修改的申请材料,申请人需补充更新后发至上述邮箱,重新提交伦理审查申请。
联系人:王琪 李一杨
联系电话:029-86177457
附件:1.西安医学院伦理审查申请汇总表
2.西安医学院伦理审查申请表(初始审查)
3.西安医学院伦理审查申请表(跟踪审查)
4.西安医学院伦理审查意见反馈表(初始审查)
5.西安医学院伦理审查意见反馈表(跟踪审查)
6.西安医学院临床研究知情同意书(参考模板)
7.西安医学院生物样本捐赠者知情同意书(参考模板)
8.西安医学院伦理审查申请研究者汇报提纲
9.西安医学院知情同意豁免申请
科技处
2025年6月5日


